Les produits IVD sont des dispositifs et des systèmes utilisés pour diagnostiquer, traiter ou prévenir des problèmes de santé. Ils sont destinés à être utilisés dans la collecte et l'examen d'échantillons biologiques tels que le sang, la salive ou les tissus. Les échantillons peuvent être prélevés à l'intérieur du nez ou à l'arrière de la gorge, ou à partir d'une veine ou d'un doigt.
Il est important de noter que les produits IVD sont non invasifs. Par exemple,
Poclight HSCL-5000 Micro analyseur d'immunoanalyse par chimiluminescence homogène
.
Cependant, ils sont toujours considérés comme des dispositifs médicaux et sont donc soumis aux mêmes contrôles. Les dispositifs médicaux comprennent tout instrument, appareil, logiciel ou dispositif connexe destiné à être utilisé par des êtres humains dans le but de :
·
Diagnostiquer, prévenir, surveiller ou traiter une maladie ou une blessure.
·
Soutenir ou maintenir la vie.
·
Conception régulatrice.
·
Désinfection des dispositifs médicaux.
·
Fournir des informations à des fins médicales en collectant des échantillons biologiques sur des êtres humains.
Les fabricants de diagnostics in vitro doivent satisfaire aux exigences réglementaires de l'Union européenne, du Royaume-Uni et des États-Unis en fonction du ou des marchés qu'ils souhaitent pénétrer.
Ces exigences incluent le règlement de diagnostic in vitro (IVDR) (UE) 2017/746 dans l'UE et le règlement britannique sur les dispositifs médicaux (UK MDR) 2002 au Royaume-Uni. Aux États-Unis, les produits de DIV sont définis à l'article 201(h) de la Federal Food, Drug, and Cosmetic Act (FD&C Act) ; ces appareils peuvent également être soumis à l'article 351 de la loi sur les services de santé publique, ainsi qu'à la catégorisation en vertu des modifications apportées à l'amélioration des laboratoires cliniques (CLIA) de 1988.
Selon l'IVDR, un produit DIV est défini comme "tout dispositif médical qui est un réactif, un produit réactif, un calibrateur, un matériel de contrôle, un kit, un instrument, un appareil, une pièce d'équipement, un logiciel ou un système, utilisé seul ou en combinaison, destiné par le fabricant pour être utilisé in vitro pour l'examen d'échantillons, y compris les dons de sang et de tissus, provenant du corps humain… »
Les experts estiment qu'environ 70 % de toutes les décisions cliniques sont prises à l'aide de produits de DIV.
Exemples de produits DIV
Les tests de grossesse, les tests COVID-19 et les tests VIH sont des exemples de produits IVD. D'autres exemples d'appareils Poclight HSCL-5000 Micro CLIA Analyzer IVD incluent :
·
Diagnostic du cancer
· Diagnostic thyroïdien
· Diagnostic inflammatoire
·
Immunodosages
· ...
Les récipients fabriqués pour les échantillons médicaux sont également des produits de DIV. Selon l'Organisation mondiale de la santé, plus de 40 000 produits sont aujourd'hui disponibles pour les tests IVD. Ceux-ci peuvent aller des tests de laboratoire traditionnels aux tests au point de service.
Classification DIV
Aux États-Unis, la FDA classe tous les dispositifs médicaux, y compris les produits de DIV, en classe I, classe II ou classe III. La classification du dispositif variera en fonction du risque encouru et du niveau de contrôle réglementaire nécessaire pour garantir la sécurité du produit. En conséquence, la classification IVD déterminera le processus de précommercialisation que le fabricant doit suivre pour mettre son produit sur le marché.
·
Les produits de classe I sont considérés comme présentant un risque faible à modéré et nécessitent des contrôles généraux.
·
Les produits de classe II sont considérés comme présentant un risque modéré à élevé et nécessitent des contrôles généraux et des contrôles spéciaux.
·
Les produits de classe III sont considérés à haut risque et nécessitent des contrôles généraux et une autorisation préalable à la commercialisation (PMA).
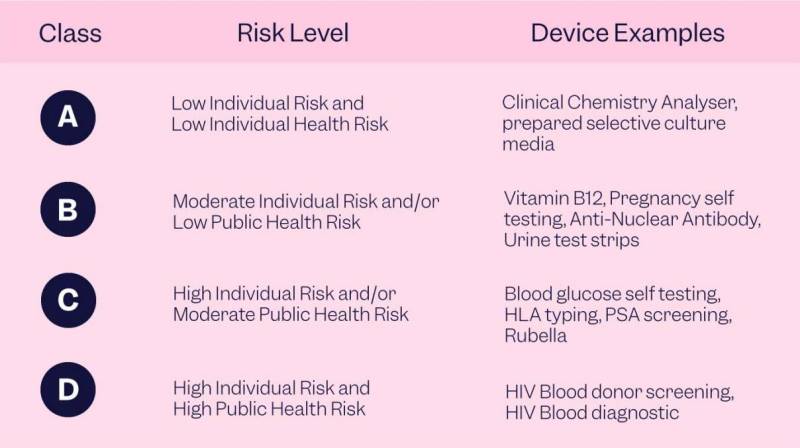
Il est important de noter qu'à mesure que la classe d'appareils augmente, les contrôles réglementaires augmentent également. Les appareils IVR de classe I sont soumis au moindre contrôle réglementaire, tandis que les appareils IVR de classe III présentent les exigences les plus strictes. Les entreprises des sciences de la vie qui cherchent à commercialiser leurs produits de diagnostic in vitro aux États-Unis peuvent se référer à la ressource « Classify Your Medical Device » de la FDA.
Vous cherchez à assurer la conformité réglementaire dans l'Union européenne ? L'IVDR a été mis à jour en 2021 pour inclure des améliorations telles que :
·
Des obligations claires pour les fabricants, les importateurs et les distributeurs concernant la traçabilité des dispositifs, l'enregistrement et la vérification de l'étiquetage approprié. Cela inclut un système de traçabilité fondé sur un identifiant unique d'appareil (UDI).
·
Introduction d'une classification composée de quatre classes de risque. Les dispositifs de classe A présentent un faible risque pour la santé individuelle et publique, les dispositifs de classe B présentent un risque modéré pour la santé individuelle et/ou publique, les dispositifs de classe C présentent un risque individuel élevé et/ou un risque modéré pour la santé publique, et les dispositifs de classe D présentent un risque individuel élevé et un risque élevé risque pour la santé publique.
·
Contrôles plus stricts pour les dispositifs de DIV à haut risque.
·
Surveillance garantie des organismes notifiés (ou des organismes tiers indépendants d'évaluation de la conformité) en renforçant un ensemble spécifique de critères.
·
Une plus grande transparence avec une base de données complète sur les dispositifs médicaux dans l'UE (appelée EUDAMED).
·
Des réglementations renforcées sur les preuves cliniques et l'évaluation des performances, avec une plus grande coordination entre les pays de l'UE, en particulier en ce qui concerne la surveillance du marché.
·
Exigences plus strictes en matière de surveillance post-commercialisation des fabricants.
·
Exigences spécifiques pour les « dispositifs internes » ou les produits de DIV fabriqués et utilisés dans le même établissement.
La commercialisation sûre et efficace d'un produit de DIV est essentielle, et la compréhension des réglementations en place est une première étape idéale.
Conclusion
Les produits de DIV constituent une ligne de défense essentielle contre divers problèmes de santé. La sécurité et la qualité des diagnostics in vitro sont essentielles, c'est pourquoi la conformité réglementaire du fabricant est si importante. Poclight est certifié CE et ISO et dispose d'une gamme complète de réactifs pour effectuer des tests sans souci.

 English
English français
français русский
русский español
español português
português العربية
العربية 日本語
日本語 Türkçe
Türkçe हिंदी
हिंदी Indonesia
Indonesia 







 Network IPv6 pris en charge |
Network IPv6 pris en charge | 